Drug Development
T cells play a cardinal role in the human immune response system. Auto- or alloantigenic recognition or mutations can provoke undesirable immune responses that lead to autoimmune or oncological diseases. In such autoimmune and oncological diseases a T cell subset called effector memory T cells (TEM) escapes the control of the immune system and destroy the body’s own tissues or become malignant.
The down-regulation of the complete T cell system by medication would ease such harmful immune responses but would also disrupt the protective immune response network. Therefore, it is desirable to target molecules whose expression is restricted to TEM cell subsets in order to maintain the overall protective immune response.
Interestingly, autoreactive and malignant TEM cells become exclusively dependent on the potassium channel Kv1.3 for maintained activation and proliferation. Kv1.3 dependency is highly restricted to these cells and Kv1.3 is therefore regarded as a target of choice for selective and specific deactivation of autoreactive TEM cells.
selectION’s si-peptides block the Kv1.3 channel with high affinity and extremely high specificity. This, in consequence, irreversibly disrupts the signaling pathway necessary for maintained TEM cell activation and proliferation. Short exposure to adequate concentrations of an si-peptide terminates the pathogenic activation and proliferation cascade of the autoreactive, disease-associated TEM cell clone, while leaving the remaining immune system untouched.
About si-544
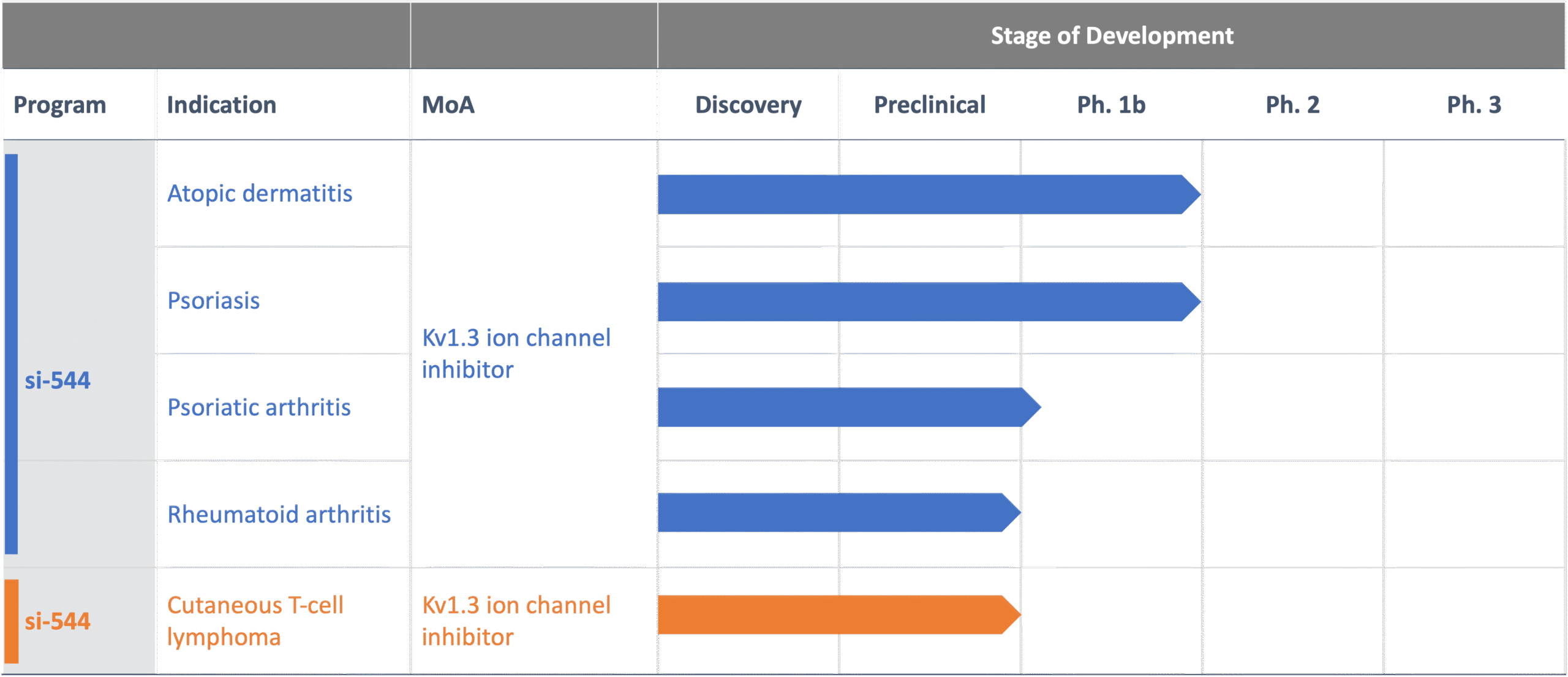
si-544, the Company´s lead candidate, selectively blocks Kv1.3, an ion channel disease-associated effector memory T (TEM) cells depend on exclusively. Kv1.3 is essential for the chronic activation and proliferation of these autoreactive cells which have escaped the control and editing mechanisms of the immune system. Autoreactive TEM cells drive inflammation in many autoimmune diseases, including atopic dermatitis, psoriasis, rheumatoid arthritis, and multiple sclerosis. In certain rare lymphomas, the tumor mass is comprised of chronically activated, Kv1.3 dependent TEM cells. Blocking Kv1.3 by si-544 disrupts the signaling pathway essential to maintain TEM cell activation and proliferation. This terminates the pathogenic chronic activation and proliferation cascade.
si-544 is a potent and highly specific immuno-selective agent addressing a huge unmet medical need by functionally inhibiting/eliminating disease-specific, chronically activated TEM cells while maintaining full immune system functionality.
si-544 has demonstrated excellent efficacy and safety in preclinical development, and the Company has successfully completed a first-in-human, Phase 1b trial for evaluating the safety and efficacy of si-544 in patients diagnosed with mild to severe atopic dermatitis. This FIH study was followed by a Phase 1b trial in patients diagnosed with mild to severe proriasis vulgaris.
selectION believes that si-544 is superior to current approaches in the treatment of autoimmune diseases, which suppress symptomatic inflammation rather than treating the underlying autoimmune condition. While these symptomatic and immunosuppressive medications ease the severity of disease presentation, they fail to treat the root cause of disease and disrupt the protective immune response network. It is obviously desirable to selectively and specifically target only disease-associated, autoreactive TEM cell clones without immunosupression.
Proprietary Portfolio: si-544
- Targets Kv1.3 to suppress proliferation of TEM cells, key drivers of inflammation in autoimmune diseases
- Excellent efficacy in a rat arthritis model
- Leaves the innate immune response untouched
Key Features: si-544
- Selectively binds to Kv1.3 with picomolar IC50
- No binding to cardiovascular ion channels Kv1.5 and hERG
- No binding to neuronal Kv1.1 and Kv1.2 channels
- Selectivity outperforms leading molecules in clinical development to date
Regulatory Status: si-544
- Initiated clinical development in 2021
- Start of Ph I: Q2/2022
Worldwide Patent Protection / IP Coverage
Composition-of-matter patent: “Kv1.3 potassium channel antagonists” PCT WO2015/169901
• Patent granted / Worldwide Coverage: US, Australia, Europe, Israel, Hongkong CAN, China, IN, JPN, KR
• Continuation application filed and already granted by the USPTO in July 2020 & Australia in October 2020
Psoriasis vulgaris / Psoriasis-Arthritis
Clinical Trial / Klinische Studie
An dieser Studie konnten Betroffene in 2024-2025 teilnehmen. Die Anmeldung ist mittlerweile geschlossen.
Eine multizentrische, doppelblinde, Placebo-kontrollierte Phase-1b-Studie zur Beurteilung der Sicherheit, Verträglichkeit, und Wirksamkeit von si-544 bei Erwachsenen mit Psoriasis vulgaris oder Psoriasis-Arthritis
- Studie: SEL-002
- Alter der Patienten: 18 – 75 Jahre
- Wirkstoff: si-544
- Darreichung: subkutane Injektion
- Studienphase: 1b
Psoriasis vulgaris (Schuppenflechte) und Psoriasis-Arthritis (Schuppenflechte-Arthritis)
In diese Studie können Patienten im Alter von 18 bis 75 Jahren aufgenommen werden, die an Psoriasis vulgaris oder Psoriasis-Arthritis leiden.
Was ist Psoriasis vulgaris (Schuppenflechte) oder Psoriasis-Arthritis (Schuppenflechte-Arthritis)?
Psoriasis ist eine der häufigsten chronischen, wiederkehrenden und entzündlichen Hauterkrankungen. Es ist eine häufige Hauterkrankung bei Kindern und betrifft weltweit 2% bis 3% der Bevölkerung insgesamt.
Psoriasis vulgaris ist die häufigste Psoriasis-Form und betrifft etwa 90% der Patienten. Charakteristisch sind rote, erhabene Hautflecke, die oft mit silbrigen Schuppen bedeckt sind.
Zu den weiteren Formen der Psoriasis zählt die Psoriasis-Arthritis. Psoriasis-Arthritis ist eine Art von Arthritis, die bei einer Untergruppe von Patienten mit Psoriasis auftritt. Es wird geschätzt, dass ca. 30% der Patienten mit Psoriasis vulgaris an Psoriasis-Arthritis leiden.
Das klinische Spektrum der Psoriasis-Arthritis ist vielfältiger Natur – periphere Gelenkentzündungen, Enthesitis (Sehnenentzündung), Tenosynovitis (Sehnenscheidenentzündung) oder Daktylitis (Entzündungen der Fingergelenke) können auftreten. Jede dieser Erkrankungen kann isoliert oder in Kombination mit anderen auftreten. Die wichtigsten klinischen Merkmale der Krankheit sind Spondylitis (Wirbelkörperentzündungen), entzündliche Nackenschmerzen, entzündliche Brustschmerzen und Rückenschmerzen.
Aktuelle Forschung hat gezeigt, dass die Ursache dieser Erkrankungen in einem fehlgeleiteten Immunsystem liegt. Aufgrund eines Fehlers reagiert das Immunsystem dann fälschlicherweise mit Entzündungen im körpereigenen Gewebe (Autoimmunerkrankung).
Sie sind an Psoriasis vulgaris (Schuppenflechte) oder Psoriasis-Arthritis (Schuppenflechte-Arthritis) erkrankt und Sie haben derzeit Krankheitssymptome. Der Sponsor der Studie entwickelt eine neue Therapie. Deswegen soll das Prüfpräparat mit dem Namen si-544 in der Studie getestet werden. Damit will der Sponsor herausfinden, ob das Prüfpräparat wirksam und sicher ist.
si-544 ist ein neuer Wirkstoff, der Immunzellen hemmt, die irrtümlich körpereigenes Gewebe angreifen. Das Prüfpräparat bindet an die Zielzellen und hemmt deren Aktivierung. Die Entwickler des Wirkstoffs hoffen, dass auf diese Weise die Entzündungen reduziert und weniger Nebenwirkungen ausgelöst werden können, als bei derzeit erhältlichen Standardtherapien. si-544 ist noch in der klinischen Prüfung und wurde für eine Behandlung bisher nicht zugelassen. Es wird derzeit bereits in einer anderen Studie in einer anderen Erkrankung bei ca. 30 Personen untersucht.
Im Rahmen dieser Studie werden Patienten 4 Wochen lang zweimal pro Wochen mit der Studienmedikation behandelt. Falls die Voruntersuchung ergibt, dass Sie für die Studie geeignet sind, wird per Zufallssystem (Randomisierung) entschieden, ob Sie das Prüfpräparat si-544 (geplant: 3 von 4 Patienten) oder eine wirkstofffreie Lösung (Placebo; geplant: 1 von 4 Patienten) erhalten. Dann wird Ihnen das Ihnen zugewiesene Präparat 2-mal pro Woche für 4 Wochen am Bauch unter die Haut gespritzt (subkutane Injektion).
Wenn Sie sich zur Teilnahme entscheiden, dauert die Studie für Sie etwa 21 Wochen (5 Monate). Sie werden in dieser Zeit 13-mal für Untersuchungen in die Prüfstelle kommen.
Am Tag der ersten und am Tag der letzten Injektion bitten wir Sie für 10 Stunden an der Prüfstelle zu bleiben, um zu mehreren Zeitpunkten Blutproben abnehmen zu lassen. An den anderen Injektionstagen bitten wir Sie nach Erhalt der Injektion für mindestens 2 Stunden zur Beobachtung an der Prüfstelle zu bleiben. Nach den 4 Behandlungswochen werden bei 4 weiteren Besuchsterminen (4 Tage, und 4, 8, und 12 Wochen nach Erhalt der letzten Injektion) an der Prüfstelle verschiedene Routine-Untersuchungen (z.B. Messung der Vitalzeichen, körperliche Untersuchung, Laboranalysen) durchgeführt, um die Sicherheit und Wirksamkeit des Prüfpräparats zu beurteilen. Hierfür wird Ihnen auch Blut abgenommen werden. Nach Abschluss der jeweils geplanten Untersuchungen können Sie die Prüfstelle wieder verlassen.
An der Studie dürfen Patienten teilnehmen, die
- 18 bis 75 Jahre alt sind,
- an Psoriasis vulgaris (Schuppenflechte) mit leichter bis schwerer Ausprägung oder an Psoriasis-Arthritis (Schuppenflechte-Arthritis) leiden,
- und anhaltende Krankheitssymptome aufweisen.
Sie können an der Studie nicht teilnehmen, wenn
- Sie schwanger sind oder stillen,
- keine wirksame Empfängnisverhütung erfolgt,
- oder Sie Ihre Standardtherapie in den letzten 4 Wochen vor Einschluss in die Studie geändert haben.
Ein Prüfarzt eines Studienzentrums wird Sie über die genauen Ein- und Ausschlusskriterien der Studie informieren.
Durch die Teilnahme an der Studie entstehen Ihnen keine Kosten.
Für die Teilnahme an der Studie / den Untersuchungen wird eine angemessene Aufwandsentschädigung gezahlt. Ihre Fahrtkosten für An- und Abreise werden pauschal in angemessener Höhe erstattet. Alle studienbezogenen Untersuchungen (Laborwerte, Beratung etc.) werden vom Sponsor der Studie bezahlt.
Die Studie wird derzeit an mehreren Studienzentren in Deutschland durchgeführt. Sie finden die Kontaktdaten der Zentren weiter unten auf dieser Seite. Sie können telefonisch, per Website oder per E-Mail mit den Zentren Kontakt aufnehmen. In einem kurzen Telefonat kann dann bereits vorab geklärt werden, ob Sie für die Studie geeignet sein könnten. Ist die Vorprüfung positiv und haben Sie weiterhin Interesse, vereinbaren Sie ein Gespräch im Testzentrum, bei dem die Voruntersuchung stattfindet.
Ein Prüfarzt wird ein Aufklärungsgespräch mit Ihnen führen. Bitte zögern Sie nicht, alle Punkte anzusprechen, die Ihnen unklar sind. Sie werden danach ausreichend Bedenkzeit erhalten, um über Ihre Teilnahme zu entscheiden. Es ist Ihre freie Entscheidung, ob Sie an dieser Studie teilnehmen möchten oder nicht. Sie können jederzeit NEIN sagen, sofort oder auch später. Sie brauchen dafür keine Gründe anzugeben und haben keine Nachteile. Wenn Sie sich für die Teilnahme entscheiden, unterschreiben Sie eine Einwilligungserklärung und können dann an der Studie teilnehmen.
PLZ-Bereich 1: Berlin / Großraum Berlin
emovis GmbH, Wilmersdorfer Str. 79, 10629 Berlin – Telefon: 030 439741610
Psoriasis
https://www.studien-in-berlin.de/studie/schuppenflechte-23-1
Klinische Studie: Schuppenflechte | Studien in Berlin | emovis by Futuremeds
Unsere klinische Studie Schuppenflechte: Auf dieser Seite finden Sie Informationen zu Schuppenflechte sowie zur dazugehörigen Studie und Möglichkeit einer Studienteilnahme. Diese Studie ist zählt zu unserer Kategorie Aktuelle Studien
www.studien-in-berlin.de
Psoriatische Arthritis
https://www.studien-in-berlin.de/studie/psoriasis-arthritis-23-1
Klinische Studie: Psoriatische Arthritis | Studien in Berlin | emovis by Futuremeds
Unsere klinische Studie Psoriatische Arthritis: Auf dieser Seite finden Sie Informationen zu Psoriatischer Arthritis sowie zur dazugehörigen Studie und Möglichkeit einer Studienteilnahme. Diese Studie ist zählt zu unserer Kategorie Aktuelle Studien
www.studien-in-berlin.de
PLZ–Bereich 2: Hamburg / Großraum Hamburg
bioskin GmbH, Messberg 4, 20095 Hamburg – Telefon: 040 606897-14
https://www.bioskin.de/studienangebot/schuppenflechte-2.html
Schuppenflechte – Dermatologische Studien in Hamburg
Alter: 18-75 Jahre Aufwandsentschädigung: von bis zu 2400 Euro plus Fahrtkosten
www.bioskin.de
PLZ–Bereich 4: Westfalen / Ruhrgebiet
Fachklinik Bad Bentheim, Am Bade 1, 48455 Bad Bentheim – Telefon: 0 59 22 74-0
https://www.fk-bentheim.de/
Atopische Dermatitis
Clinical Trial / Klinische Studie
An dieser Studie konnten Betroffene in 2022-2023 teilnehmen. Die Anmeldung ist mittlerweile geschlossen.
Eine multizentrische, doppelblinde, Placebo-kontrollierte Phase 1b-Studie, mit aufsteigender Einzel- und Mehrfachdosierung, zur Beurteilung der Sicherheit, Verträglichkeit, und Wirksamkeit von si-544 bei Erwachsenen mit atopischer Dermatitis
- Studie: SEL-001
- Alter der Patienten: 18 – 75 Jahre
- Wirkstoff: si-544
- Darreichung: subkutane Injektion
- Studienphase: 1b
Atopische Dermatitis
In diese Studie können Patienten im Alter von 18 bis 75 Jahren aufgenommen werden, die an Atopischer Dermatitis mit leichter bis schwerer Ausprägung leiden.
Was ist Atopische Dermatitis?
Atopische Dermatitis, auch bekannt als atopisches Ekzem oder Neurodermitis, ist eine facettenreiche, chronisch wiederkehrende, entzündliche Hauterkrankung. Es ist die häufigste Hauterkrankung bei Kindern und betrifft weltweit etwa 15 % bis 20 % der Kinder und 1 % bis 3 % der Erwachsenen. Das charakteristische Merkmal der Krankheit ist ein starker Juckreiz. Neben starkem Juckreiz und trockener Haut finden sich Ekzeme je nach Alter an unterschiedlichen Körperoberflächen, insbesondere an den Extremitäten und im Kopf-/Halsbereich. Weitere klinische Merkmale sind Nässen und Krustenbildung und eine Verdickung der Haut (Lichenifikation). Häufige Komplikationen der Erkrankung sind Infektionen durch Keime (Staphylococcus aureus), Virusinfektionen und Mykosen.
Aktuelle Forschung hat gezeigt, dass die Ursache der Erkrankung in einem fehlgeleiteten Immunsystem liegt. Aufgrund eines Fehlers reagiert das Immunsystem dann fälschlicherweise mit Entzündungen im körpereigenen Gewebe (Autoimmunerkrankung).
Sie sind an atopischer Dermatitis (auch bekannt als Neurodermitis) erkrankt und haben trotz Behandlung mit der Standardtherapie weiterhin anhaltende Krankheitssymptome. Der Sponsor der Studie entwickelt eine neue Therapie. Deswegen soll das Prüfpräparat mit dem Namen si-544 in der Studie getestet werden. Damit will der Sponsor herausfinden, ob das Prüfpräparat wirksam und sicher ist.
si-544 ist ein neuer Wirkstoff, der Immunzellen hemmt, die irrtümlich körpereigenes Gewebe angreifen. Das Prüfpräparat bindet an die Zielzellen und hemmt deren Aktivierung. Die Entwickler des Wirkstoffs hoffen, dass auf diese Weise die Entzündungen reduziert und weniger Nebenwirkungen ausgelöst werden können, als bei derzeit erhältlichen Standardtherapien. si-544 ist noch in der klinischen Prüfung und wurde für eine Behandlung bisher nicht zugelassen. Es wird in dieser Studie zum ersten Mal bei Menschen angewendet.
Die Studie wird in 2 Teilen durchgeführt – im ersten Teil der Studie erhalten die Patienten die Prüfmedikation nur ein einziges Mal, im zweiten Teil der Studie werden Patienten 4 Wochen lang zweimal pro Wochen mit der Studienmedikation behandelt.
Aktuell werden nur Patienten für den ersten Studienteil (Einzeldosierung) rekrutiert. Im ersten Studienteil werden 5 verschiedene Dosen des Prüfpräparats jeweils 4 Patienten als Einzeldosis verabreicht, um die Sicherheit der jeweiligen Dosis zu untersuchen. Falls die Voruntersuchung ergibt, dass Sie für die Studie geeignet sind, wird per Zufallssystem (Randomisierung) entschieden, ob Sie das Prüfpräparat si-544 (geplant: 3 von 4 Patienten) oder eine wirkstofffreie Lösung (Placebo; geplant: 1 von 4 Patienten) erhalten. Dann wird Ihnen das Ihnen zugewiesene Präparat einmalig am Bauch unter die Haut gespritzt (subkutane Injektion).
Nach Erhalt der Injektion bitten wir Sie mindestens 2 Stunden zur Beobachtung an der Prüfstelle zu bleiben. Je nachdem in welcher Dosis-Gruppe (Kohorte) Sie teilnehmen, kann es sein, dass Sie gebeten werden 8 Stunden an der Prüfstelle zu bleiben, um zu mehreren Zeitpunkten Blutproben abnehmen zu lassen. Ihr Prüfarzt wird Ihnen vorab mitteilen wieviel Zeit Sie für den Besuch am Zentrum mindestens einplanen sollten. Danach werden bei 2 weiteren Besuchen (3 Tage und 7 Tage nach Erhalt der Injektion) an der Prüfstelle verschiedene Routine-Untersuchungen (Messung der Vitalzeichen, körperliche Untersuchung, Laboranalysen) durchgeführt, um die Sicherheit des Prüfpräparats zu beurteilen. Hierfür wird Ihnen auch Blut abgenommen werden.
Nach Abschluss der jeweils geplanten Untersuchungen können Sie die Prüfstelle wieder verlassen.
Insgesamt dauert dieser Studienteil für Sie etwa 2 Wochen. Sie werden in dieser Zeit 4mal für Untersuchungen in die Prüfstelle kommen.
An der Studie dürfen Patienten teilnehmen, die
- 18 bis 75 Jahre alt sind,
- an Atopischer Dermatitis mit leichter bis schwerer Ausprägung leiden,
- und trotz Behandlung mit der Standardtherapie weiterhin anhaltende Krankheitssymptome aufweisen.
Sie können an der Studie nicht teilnehmen, wenn
- Sie schwanger sind oder stillen,
- keine wirksame Empfängnisverhütung erfolgt,
- oder Sie Ihre Standardtherapie in den letzten 4 Wochen vor Einschluss in die Studie geändert haben.
Ein Prüfarzt eines Studienzentrums wird Sie über die genauen Ein- und Ausschlusskriterien der Studie informieren.
Durch die Teilnahme an der Studie entstehen Ihnen keine Kosten.
Für die Teilnahme an der Studie / den Untersuchungen wird eine angemessene Aufwandsentschädigung gezahlt. Ihre Fahrtkosten für An- und Abreise werden pauschal in angemessener Höhe erstattet. Alle studienbezogenen Untersuchungen (Laborwerte, Beratung etc.) werden vom Sponsor der Studie bezahlt.
Die Studie wird derzeit an 4 Studienzentren in Deutschland durchgeführt. Sie finden die Kontaktdaten der Zentren weiter unten auf dieser Seite. Sie können telefonisch mit den Zentren Kontakt aufnehmen. In einem kurzen Telefonat kann dann bereits vorab geprüft werden, ob Sie für die Studie geeignet sein können. Ist die Vorprüfung positiv und haben Sie weiterhin Interesse, vereinbaren Sie ein Gespräch im Testzentrum, bei dem die Voruntersuchung stattfindet.
Ein Prüfarzt wird ein Aufklärungsgespräch mit Ihnen führen. Bitte zögern Sie nicht, alle Punkte anzusprechen, die Ihnen unklar sind. Sie werden danach ausreichend Bedenkzeit erhalten, um über Ihre Teilnahme zu entscheiden. Es ist Ihre freie Entscheidung, ob Sie an dieser Studie teilnehmen möchten oder nicht. Sie können jederzeit NEIN sagen, sofort oder auch später. Sie brauchen dafür keine Gründe anzugeben und haben keine Nachteile. Wenn Sie sich für die Teilnahme entscheiden, unterschreiben Sie eine Einwilligungserklärung und können dann an der Studie teilnehmen.
PLZ Bereich 1: Berlin / Großraum Berlin
emovis GmbH, Wilmersdorfer Str. 79, 2. OG, 10629 Berlin – Telefon: 030 439741610
https://www.studien-in-berlin.de/studie/neurodermitis-23-1
PLZ–Bereich 2: Hamburg / Großraum Hamburg
bioskin GmbH, Messberg 4, 20095 Hamburg – Telefon: 040 606897-14
https://www.bioskin.de/studienangebot/neurodermitis-leicht-bis-mittelschwer.html
PLZ–Bereich 3: Magdeburg
Hautambulatorium Magdeburg, Franckestr. 1, 39104 Magdeburg – Telefon: 0391 541-3616
https://www.haut-ambulatorium.de/studienzentrum
PLZ–Bereich 4: Wuppertal / Großraum Rhein-Ruhr
CentroDerm GmbH, Heinz-Fangman-Straße 57, 42287 Wuppertal – Telefon: 0202 629337-36
https://centroderm.de/clinical_trials/9
PLZ–Bereich 6: Mainz / Großraum Rhein-Main
Dermatologie Drs. Quist – Studienzentrum, Haifa-Allee 20, 55128 Mainz – Telefon: 0178-5478457
https://dermatologie-quist.de/forschung/derzeitige-klinische-studien
Pipeline
Partnerships

Bachem AG (www.bachem.com)

FGK Clinical Research GmbH (www.fgk-cro.com)

Granzer Regulatory Consulting & Services GmbH (www.granzer.biz)
